Confira itens alterados na RDC 751
Informativos . 02/03/23
Foi publicado hoje, em 02 de março de 2023, a RDC nº 777, de 1º de março de 2023, que altera a RDC nº 751, de 15 de setembro de 2022, que dispõe sobre a classificação de risco, os regimes de notificação e de registro, e os requisitos de rotulagem e instruções de uso de dispositivos médicos.
Em vigor desde 1º de março de 2023, a RDC nº 751/2022 atualiza as regras sanitárias sobre a classificação de risco, os regimes de regularização, os requisitos de rotulagem e instruções de uso de dispositivos médicos
Conforme discutido na 2ª Reunião Ordinária Pública da Diretoria Colegiada da ANVISA, em 01 de março de 2023, a alteração visa adequações e correções de textos da norma, para melhor entendimento dos requisitos regulatórios para o setor regulado. A Agência esclareceu também que as mudanças são de baixo impacto regulatório, sem prejuízos aos agentes econômicos ou usuários dos serviços, uma vez que a alteração não traz novas obrigações.
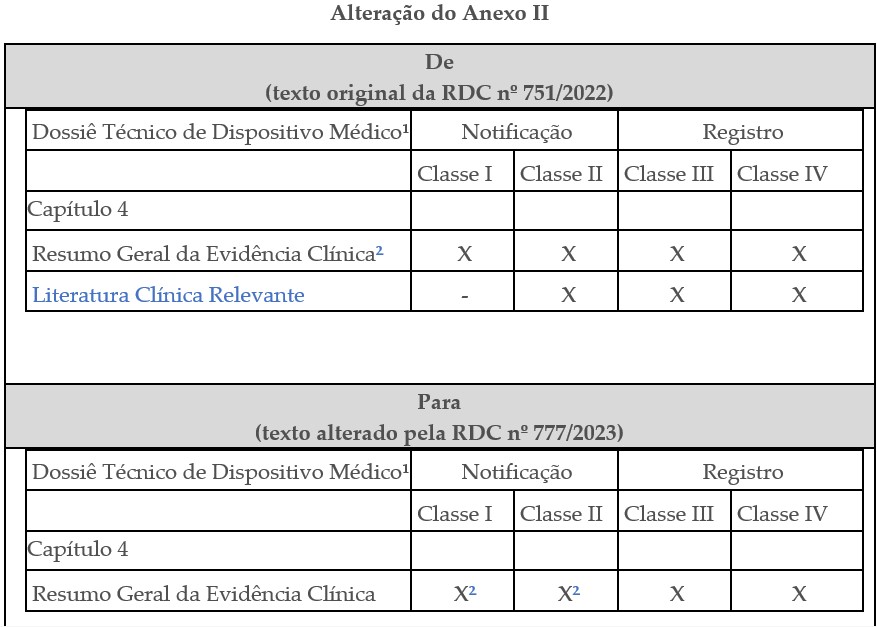
Abaixo, segue uma tabela comparativa com as alterações realizadas no texto da RDC nº 751/2022:
| Item | De (texto original da RDC nº 751/2022) | Para (texto alterado pela RDC nº 777/2023) |
|---|---|---|
| Art. 2º – §3º | “§3º Esta Resolução não se aplica aos dispositivos médicos personalizados, […]” | “§ 3º Esta Resolução não se aplica aos dispositivos médicos sob medida, […]” |
| —/— | —/— | —/— |
| Art. 16 – §1º | § 1º O peticionamento das alterações constantes dos incisos I e II deste artigo deverá observar o disposto na Instrução Normativa – IN nº 74, de 16 de setembro de 2020, publicada no DOU nº 180, de 18 de setembro de 2022, Seção 1, pag. 111, que detalha os assuntos de peticionamento aplicáveis. | § 1º O peticionamento das alterações constantes dos incisos I e II deste artigo deverá observar o disposto na Instrução Normativa – IN nº 74, de 16 de setembro de 2020, publicada no DOU nº 180, de 18 de setembro de 2020, Seção 1, pag. 111, que detalha os assuntos de peticionamento aplicáveis.” |
| —/— | —/— | —/— |
| Art. 22 | “Art. 22. As alterações de implementação imediata serão publicadas no Diário Oficial da União e, quando aplicável, os dados atualizados serão publicizados no portal eletrônico da Anvisa, observado o prazo de até 30 (trinta) dias, contado da finalização do protocolo da respectiva petição, independentemente de análise documental por parte da Anvisa”. | “Art. 22. As alterações de implementação imediata serão publicadas no Diário Oficial da União e, quando aplicável, os dados atualizados serão publicizados no portal eletrônico da Anvisa, independentemente de análise documental por parte da Anvisa.” |
| —/— | —/— | —/— |
| Art. 39 | “Art. 39. A Anvisa poderá suspender a fabricação, importação, comercialização e uso do dispositivo médico nos casos em que: I – for suspensa, por razão de segurança devidamente justificada, a validade de qualquer um dos documentos referidos nos artigos 13 e 14 desta Resolução; II – for comprovado o não cumprimento de qualquer exigência do Capítulo III, Seção VII desta Resolução; ou III – o produto estiver sob investigação por autoridade sanitária competente, quanto à irregularidade ou defeito do produto ou processo de fabricação, que represente risco à saúde do usuário, paciente, operador ou terceiros envolvidos, devidamente justificado”. | “Art. 39. A Anvisa poderá suspender a fabricação, importação, distribuição, comercialização e uso do dispositivo médico em caso de risco sanitário originado por irregularidade no produto, irregularidade em seu processo de fabricação, ausência de certificado de conformidade compulsório ou condição diversa da regularização aprovada junto à Anvisa.” |
| —/— | —/— | —/— |
| Art. 40 | “Art. 40. A suspensão da fabricação, importação, comercialização e uso de dispositivo médico será publicada no Diário Oficial da União e será mantida até a solução do problema que ocasionou a sanção e sua anulação seja comunicada”. | Artigo revogado |
| —/— | —/— | —/— |
| Art. 43 | “Art. 43. A Anvisa poderá a seu critério e a qualquer tempo solicitar informações ou esclarecimentos antes da decisão de cancelamento da notificação irregular de dispositivo médico”. | “Art. 43. A Anvisa poderá a seu critério e a qualquer tempo solicitar informações ou esclarecimentos antes da decisão de cancelamento da notificação ou do registro irregular de dispositivo médico.” |